传统的萃取分离法主要采用与水互不相溶的有机溶剂作萃取溶剂,这种异相萃取有些传质速率低,分配系数比较小,必须经过较长时间振荡或多次萃取才能达到定量萃取,工作量较大,而大多使用的萃取溶剂常是易挥发、易燃和有毒,所以应用上受到限制。为此,利用挥发性小、无毒、易溶于水的有机溶剂作为萃取溶剂进行均相萃取、在盐析剂的作用下,进行异相分离的快速萃取体系可以克服异相萃取分离技术中的一些缺点而受到重视。而以乙醇为萃取溶剂,均相萃取、异相分离钯的研究发现,硫酸铵存在下,在一定酸度的介质中,乙醇与水分相过程中,钯(II)与硫氰根负离子形成的二阶硫氰酸钯负离子与质子化乙醇酒精离子形成电中性的缔合物酒精离子;二阶硫氰酸钯负离子被乙醇相完全萃取,能使钯(II)从铝(III)、锰(II)、铁(II)、铀(VI)、锡(II)、钒(V)的混合溶液中分离。在这里乙醇既是萃取剂又是萃取溶剂。这种萃取钯(II)的体系与传统的水杨醛-羟胺-苯和(β-巯基氢化肉桂酸异戊脂)-苯等萃取钯(II)的体系相比,具有萃取效率高,操作简便,不污染环境等优点。
一、实验部分
1、仪器和试剂
钯(II)标准溶液(0.1毫克/毫升),硫酸铵(分析纯),无水乙醇(分析纯),硫氰酸氨(分析纯),用氯化钾-盐酸、邻苯二甲酸氢钾-盐酸和邻苯二甲酸氢钾-氢氧化钠分别配制pH值1-2,pH值3和pH值4-6的缓冲溶液,所用其他试剂均为分析纯。仪器为Cintra 10型紫外可见分光仪,VIS-723型分光光度计,pH S-3C精密pH计。
2、实验方法
于25ml磨口比色管中,加入一定量金属离子试液和无水乙醇,用缓冲溶液调节pH,用水稀释至10毫升,再加入一定量固体硫酸铵和硫氰酸铵,摇荡约0.5分钟,静置片刻,待溶液分为水-乙醇两相后,移取乙醇相或下层盐水相,用双硫腙分光光度法测量被萃取到乙醇相或下层盐水相中钯(II)的浓度,其他金属离子的测定也按相应的分光光度法测定,根据测定结果计算萃取率。
二、结果与讨论
1、水溶液与乙醇分相条件的选择
固定乙醇在水溶液中的浓度,分别加入不同量的碳酸钠、硝酸钠、氯化钠、氯化铵、硫酸铵作分相试验,结果发现,只有硫酸铵与碳酸钠能使水与乙醇分相,这表明二价阴离子具有较强的盐析作用及分相能力,且随乙醇浓度不同,分相时所需盐的量也不同,结果见图1。
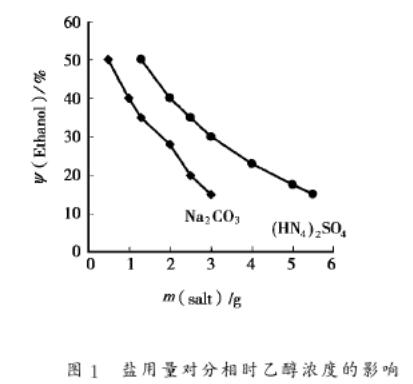
乙醇浓度增加时,自由水分子浓度降低,水-乙醇分相时所需盐的量相应减小,乙醇浓度减小时,分相时所需盐的量就越大。这表明乙醇与水分相所需盐的用量与它们的相对含量大小有关,这可能是当溶液中水对盐的水合作用到一定程度时,水与乙醇才能分相。因此可以通过改变盐的用量来控制所需乙醇相的体积。碳酸钠的分相能力大于硫酸铵,这与二阶碳酸根负离子和二阶硫酸根负离子的水合作用能力相一致,但二阶碳酸根负离子能与大多数金属离子生成碳酸盐沉淀,所以实验中选择硫酸铵作为盐析剂。
当总体积为10毫升,无水乙醇浓度为0.3毫升/毫升,硫酸铵浓度为0.2克/毫升时,析出乙醇相体积为4.1毫升,说明有部分水进入了乙醇相;当硫酸铵浓度增至0.3克/毫升,乙醇相体积为3.05毫升,表明随着盐用量的增加,水与乙醇分离趋于完全。
溶液的酸度对分相有很大的影响,分相时随着溶液酸度的增高盐的用量增大,在pH值4以上时,0.25克/毫升硫酸铵可以使水与乙醇分相;pH值1-3时,硫酸铵浓度须增至0.3克/毫升;在pH值为0时,不论硫酸铵浓度为多大,水与乙醇都不能分相,这可能是在高酸度下,二阶硫酸根负离子转变为硫酸氢铵负离子而使其盐析作用大大减弱。



